|

Projektbeschreibung:
Innerhalb des Leitprojekts Zöliakie sollte zunächst nachgewiesen werden, welche Bestandteile des Klebers toxisch sind. Die Ausgangshypothese war, nur
Gliadin ist toxisch (so auch in der Literatur beschrieben)
Sollten auch Glutenine toxisch sein, wollten die Gruppen diese entsprechend modifizieren, damit sie keine Toxizität* mehr für die Zöliakiebetroffenen aufweisen.
Einzelne Speicherproteingene wurden hierfür in die Labor-Hefe „Saccharomyces cerevisiae“ und in Mais (Zea mays) transformiert und in großen Mengen gebildet.
Die so gebildeten Proteine wurden danach isoliert,
aufgereinigt, charakterisiert und auf ihre Toxizität hin geprüft.

Definition Toxizität:
...(engl.) toxicity, giftige, u.U. gesundheitsschädigende, grundsätzlich
von der Dosis abhängige Eigenschaft und Wirkung von chemischen
Substanzen und physikalischen Faktoren, [...] Vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 1673
 Seitenanfang
Seitenanfang
Projektdauer:
Die Laufzeit des Leitprojekts betrug insgesamt 5
Jahre. - (01. 02. 2000 bis 31. 01. 2005) -
Projektförderung/Finanzierungsträger:
Das Forschungsprojekt wurde vom Bundesministerium für
Bildung und Forschung (=BMBF) gefördert und von verschiedenen Unternehmen
und Verbänden, die sich im „Verein* zur gentechnischen
Verbesserung von Getreideprodukten e.V.“ zusammengeschlossen haben,
unterstützt.
*U.a. ist die auch die DZG e.V. Mitglied dieses
Vereins.
 Seitenanfang
Seitenanfang
Kooperationspartner
des Projekts:
In dem vom Bundesforschungsministerium (BMBF) unterstützten
Projekt beteiligten sich u.a. universitäre Arbeitsgruppen aus München, Hamburg, Berlin und London.
Prof. Dr. Knie,
Ulmer Spatz Diamalt, Ulm, Deutschland
Dr. Wieser,
Deutsche Forschungsanstalt für Lebensmittelchemie (DFA) Garching, München,
Deutschland
Frau Dr. Gunvor
Pohl-Apel, Fa. Biolinx GmbH, Deutschland (Projektkoordination)
Prof. Lörz,
Universität Hamburg, Hamburg, Deutschland
Prof. Zunft, DIFE
Potsdam Rehbrücke, Potsdam, Deutschland
Dr. Chris Tapsell,
Monsanto Deutschland GmbH, Silstedt, Deutschland
Prof. Dr. Ciclitira,
The Rain Institute London, London, Großbritannien
 Seitenanfang
Seitenanfang
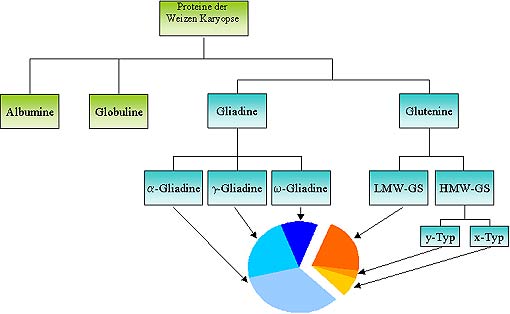
Proteinanteile
des Weizenkorns:
Das Kleberprotein Gluten* des Weizens besteht aus
komplexen Molekülen, den Gliadinen* und die Gluteninen*, die jeweils
erneut aus verschiedenen Untereinheiten zusammengesetzt sind. (vgl. Abbildung 1:
Die Gliadine und Glutenine sowie ihre jeweiligen Untereinheiten werden in türkis dargestellt)
Gluten kommt in vielen Getreidearten,
wie in Weizen, Roggen, Gerste, u.a. vor. Gluten ist zwar unlöslich in Wasser kann
aber circa die zweifache Menge des Eigengewichts an Wasser aufnehmen (=hohes
Wasserbindungsvermögen).
Backeigenschaften bzw. Backqualität werden von Menge (Quantität) und
durch die jeweilige unterschiedliche Zusammensetzung von Glutenfraktionen in den
verschiedenen Getreidearten bestimmt.
Gluten ist also beim Backvorgang
aufgrund seiner viskosen und elastischen Eigenschaften von
entscheidender Bedeutung für den Erhalt qualitativ guter, lockerer
Backerzeugnisse mit poröser Krume. (=Kombination von Elastizität und
Viskosität des Teigs.)

Definition Gluten: = Klebereiweiß;
Getreideproteine, bestehen etwa aus gleichen Anteilen aus Prolaminen
und Glutelinen; bewirken durch ihren Prolamingehalt die Backfähigkeit
des Mehls;[...] vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 616
Definition Prolamine: [...] =
Bestandteile des Glutens, [...] zu den Prolaminen gehören Gliadin
(Weizen, Roggen), Hordein (Gerste), [...] vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S.
1359
Definition Glutenin: Glutelin
des Weizens vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 616
|
|
|
Abbildung1: Proteinanteile
im Weizenkorn
Quelle:
Foliensatz: Vortrag Brühl 2 / 6 © Pohl-Apel 2005 |
 Seitenanfang
Seitenanfang
Zahlreiche
Untersuchungen haben gezeigt, dass die Gliadinfraktion insgesamt und auch alle darin enthaltenen Gliadintypen (α, γ, ω-Gliadine) für die zöliakietoxische Wirkung von Weizen verantwortlich sind.
Daher ging man innerhalb der
Zöliakieforschung bisher von der Annahme aus, dass
ausschließlich die Gliadinfraktionen die schweren Veränderungen der Dünndarmschleimhaut
bis hin zur vollständigen Zottenatrophie bei Zöliakiebetroffenen
hervorrufen würden. (vgl.
Abb. 1)
Des Weiteren wurde angenommen,
dass die
Glutenine
nicht zöliakieauslösend sind.
|
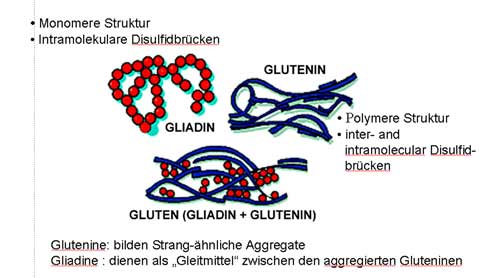
In Abbildung 2
werden
die molekularen Strukturen des Weizen-Glutens abgebildet.
Das Gliadin - hier als rote Kugeln dargestellt
- besteht
aus einem einzelnen Strang, der durch Schwefelbrücken zu einem
lockeren Netzwerk verbunden ist.
Bei dem Glutenin liegt hingegen eine polymere Struktur
vor: Es existieren kürzere Stränge, in blau dargestellt, die ebenfalls durch Schwefelbrücken miteinander verbunden sind.
Der biochemische Aufbau der Untereinheiten
LMW (=niedermolekular) und HMW
(=hochmolekular) ist sehr unterschiedlich.
Da sich das Gliadin in das Glutenin einlagert, ist
es generell schwierig, etwas über die Toxizität* des Glutenins aussagen zu
können. Die Gewinnung eines reinen Glutenins durch einen
Aufreinigungsprozeß ist problematisch.
Aus diesem Grund wurde im Leitprojekt
Zöliakie primär ein gentechnischer Forschungsansatz bzw.
entsprechende Methoden gewählt, um die
Gewinnung eines reinen Glutenins, welche als Voraussetzung für die
Durchführung weiterer Forschungsschritte wichtig ist, ermöglichen zu
können.
|
|
|
Abbildung 2:
Molekulare Struktur des Weizen-Glutens
Quelle:
Foliensatz: Vortrag Brühl 2 / 8 © Pohl-Apel 2005 |
 Seitenanfang
Seitenanfang
Aufgabenschwerpunkte
/ Zielsetzungen des Projekts:
Es ergaben sich für
dieses Projekt drei primäre Aufgabenschwerpunkte bzw. Zielsetzungen:
1.)
Die
kleintechnische Gewinnung / Produktion von
Kleberproteinen aus Hefe bzw. Mais.
2.)
Die Überprüfung der
Toxizität der Weizenkleberproteine.
3.)
Die Herstellung
von Mahlprodukten aus genmodifiziertem
Weizen bzw. Mais sowie die Verarbeitung von
Mahlprodukten aus genmodifiziertem Weizen
bzw. Mais zu
Zwischen- und Endprodukten.
 Seitenanfang
Seitenanfang
Aufgabenschwerpunkt
1:
Die
kleintechnische Gewinnung / Produktion von Kleberproteinen aus Hefe bzw. Mais.
Zur Bestätigung der o.g. Arbeitshypothese,
dass ausschließlich die Gliadine und nicht die Glutenine
das Potential zur Auslösung der Zöliakie besitzen, wurde zunächst
mit Hilfe gentechnischer Verfahren
hochreines Glutenin,
bzw. die Untereinheiten LMW und HMW sowie die Gliadin-Untereinheiten
in Hefe in einem speziellen 100-Liter-Fermenter* hergestellt. (vgl.
Abb. 3)
|

|
|
Abbildung 3:
Fermenter
Quelle:
Foliensatz: Vortrag Brühl 2 / 10 © Pohl-Apel 2005 |
 Seitenanfang
Seitenanfang
Aufgabenschwerpunkt
2:
Die Überprüfung der
Toxizität der Weizenkleberproteine.
Die Proteine Gliadin und Glutenin wurden
anschließend in in-
vitro*- Untersuchungen
innerhalb
von Zellkulturen sowie in- vivo*-Untersuchungen
an Zöliakiebetroffenen auf ihr zöliakieauslösendes Potential hin
erforscht.
Toxizitätstestverfahren in vitro:
Die immunologischen Untersuchungen erfolgten an T-Lymphozyten, die
nach Stimulation mit einem Glutenhydrolysat aus dem Dünndarmgewebe
von Zöliakiebetroffenen isoliert worden waren. Die so gewonnen Zellen wurden danach
mittels Gliadin zur Bildung von Botenstoffen angeregt. Nur diejenigen Zellen, die
bei diesem Test mit der
Bildung von Botenstoffen reagierten, konnten für weitere Testschritte
genutzt werden.
Im nächsten Schritt wurden die aus Blut gewonnenen Antigen-präsentierenden Zellen
mit dem Hydrolysat der HMW-Untereinheiten des Glutenins
zur Reaktion gebracht.
Dann wurden die eingangs gewonnenen T-Zellen und die vorbehandelten
Antigen-präsentierenden Zellen mit radioaktiv markiertem H-Thymidin
inkubiert.
Ein Teil des Hydrolysats wurde nach Behandlung mit Gewebetransglutaminase untersucht.
Als Maß für die Stimulationswirkung diente der Anstieg der Radioaktivität in den vermehrten T-Zellen im Vergleich zum Leerversuch.
(Stimulationsindex=Messgröße, inwieweit das zu untersuchende Peptid in vitro
toxisch auf das Dünndarmgewebe der Zöliakiepatienten wirkt.)
Toxizitätstestverfahren in vivo: (Durchführung durch Prof. Dr.
Ciclitira)
Als Testpersonen für die in-vivo-Untersuchungen haben sich vier
erwachsene Zöliakiepatienten zur Verfügung gestellt, die sich vor Durchführung
der Untersuchung strikt glutenfrei ernährt (=glutenfreie Diät)
hatten und demnach über eine intakte Dünndarmschleimhaut verfügten.
Das Hydrolysat der HMW-Untereinheiten des Glutenins (circa 400 mg) wurde in Wasser gelöst und in
den Dünndarm der Testpersonen instilliert*.
Zu Beginn der Instillation sowie zwei, vier und sechs Stunden danach wurde mit einer
Quinton-Kapsel
(=Biopsie) Gewebe entnommen und anschließend mikroskopisch untersucht.
Als Maß für die Toxizität des zu untersuchenden Peptids
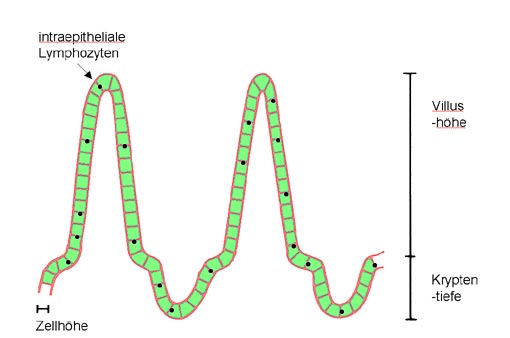
fungierten hierbei die Veränderungen folgender Parameter: (vgl.
Abb. 4)
 der Enterozytenhöhe,
der Enterozytenhöhe,
 des Verhältnisses der Villushöhe zur
des Verhältnisses der Villushöhe zur
Kryptentiefe
 sowie der Anzahl intraepithelialer
sowie der Anzahl intraepithelialer
Lymphozyten.
Bei allen Testpersonen war bereits nach zwei Stunden bezüglich
aller drei Parameter eine Wirkung zu beobachten, die nach
vier bzw. sechs Stunden ein hochsignifikantes Ausmaß erreichte.
 Seitenanfang
Seitenanfang
Definition
Fermenter: [...] meist geschlossener Behälter
unterschiedlicher Größe zur Durchführung biochemischer
Reaktionen, besonders für die Massenproduktion von Mikroorganismen
in Forschung und Industrie. vgl. Baer; Wermke: Duden.
das große Fremdwörterbuch. 2. Auflage, S. 449
Definition
in vitro: (lat.) im (Reagenz-)Glas, d.h. außerhalb des lebenden
Organismus; vgl. in vivo vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 810
Definition
in vivo: (lat.) am Lebendigen: in einem lebenden Organismus;
vgl. in vitro vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 810
Definition
instillieren: (aus lat. instillare "darauf träufeln,
einflößen"): Flüssigkeiten in den Organismus einträufeln
(Med.) vgl. Baer; Wermke: Duden. das große
Fremdwörterbuch. 2. Auflage, S. 625
 Seitenanfang
Seitenanfang
Testergebnisse:
Innerhalb beider
o.g. Toxizitätstests konnten Nachweise für die zöliakiespezifische
Toxizität von HMW- und LMW-Untereinheiten von Gluteninen erbracht
werden.
|
|
|
Abbildung 4: Parameter
des Toxizitätstests in vivo
Dünndarmschleimhaut
(vereinfachte, schematische Darstellung)
Quelle:
Foliensatz: Vortrag Brühl 2 / 14 © Pohl-Apel 2005 |
 Seitenanfang
Seitenanfang
Aufgabenschwerpunkt
3:
Die Herstellung
von Mahlprodukten aus genmodifiziertem Weizen bzw. Mais sowie die Verarbeitung von Mahlprodukten aus genmodifiziertem Weizen bzw. Mais zu
Zwischen- und Endprodukten.
3.1) Die Herstellung eines backfähigen Mais ohne
Zöliakie-Toxizität.
Hierbei war eine Übertragung von Weizen-Gluteninen
in Mais vorgesehen. Dadurch sollte die Backqualität des Mais deutlich
verbessert werden und somit ein neuartiger Rohstoff für die Bereitung
verschiedenster Lebensmittel für Zöliakiepatienten zur Verfügung
gestellt werden.
3.2) Die Herstellung eines Weizens ohne Zöliakie-Toxizität.
Im Weizen sollten die Gliadin-Gene
gentechnologisch sowie über konventionelle Züchtungsmethoden
ausgeschaltet werden.
 Seitenanfang
Seitenanfang
Ergebnispräsentation:
Die Annahme, dass ausschließlich die
Gliadinfraktionen,
nicht die Glutenin-Untereinheiten des Glutens toxisch für
Zöliakiebetroffene sind, wurde widerlegt.
Sowohl
die Ergebnisse der in-vitro- als auch der in-vivo-Toxizitätstests
ergaben:
Die
untersuchten HMW- und LMW-Glutenin-Untereinheiten sind toxisch für
Zöliakiebetroffene!
|
Konsequenzen
für das Leitprojekt Zöliakie:
1)
Aufgrund der o.g. Ergebnisse wurde die
Forschung zur
Herstellung eines backfähigen Mais
ohne Zöliakie-Toxizität
eingestellt.
2) Da es
nicht sinnvoll ist, einen Weizen ganz ohne
Kleberproteine herzustellen, wurde die
Forschung zur
Herstellung eines Weizens ohne Zöliakie-Toxizität
ebenfalls eingestellt.
3) Die Methode, die bei dem Leitprojekt Zöliakie
bezüglich des Weizens
entwickelt wurde, könnte
eventuell zukünftig bei der
Untersuchung von anderen
allergieauslösenden
Proteinen Anwendung finden.
4) Weiterführung der Immunmodulation*
 Seitenanfang
Seitenanfang
Ein Antrag
auf Verlängerung des Projekts wurde durch das Bundesministerium für
Bildung und Forschung (=BMBF) aus politischen
Gründen abgelehnt.
Es
besteht die Hoffnung, zusätzlich Gelder für das Leitprojekt
Zöliakie zu
erhalten, um eine systematische Untersuchung aller
Glutenin-Untereinheiten auf eine mögliche Toxizität hin,
zukünftig weiterhin finanzieren zu können. (vgl.
zukünftige Forschungserfordernisse)

Definition
Immunmodulation: [...] (engl.) immunomodulation;
Veränderung der Immunantwort durch verschiedene Substanzen im Sinne
einer positiven Unterstützung (Immunstimulation) oder negativen
Beeinflussung (Immunsuppression) [...] vgl. De
Gruyter: Pschyrembel. Klinisches Wörterbuch. 259. Auflage, 2002, S. 781
 Seitenanfang
Seitenanfang
Zukünftige
Forschungserfordernisse:
In
Zukunft sind laut Aussage von Frau Dr. Pohl-Apel u.a. folgende
Schwerpunkte bezüglich Zöliakieforschung relevant:
1) Die Durchführung systematischer Untersuchungen
zur Toxizität
definierter Abschnitte der Glutenin-Untereinheiten. Es besteht
diesbezüglich die Annahme, dass nicht das
gesamte Peptid
toxisch ist. (=Grundlagenforschung)
2) Die Untersuchung der Glutenin-Untereinheiten in anderen
Weizensorten. (älterer Weizensorten)
Forschungsfrage: Sind die Glutenin-Untereinheiten z.B. bei älteren
Weizensorten ähnlich oder anders strukturiert als bei den aktuell
kultivierten Sorten?
3) Die immunologische Grundlagenforschung sollte
zudem vom
Gliadin auf das Glutenin erweitert werden.
 Seitenanfang
Seitenanfang
Weitere
Informationen zum Leitprojekt Zöliakie "Die Entwicklung von Weizen-, Roggen- und Gerstenproteinen ohne Zöliakietoxizität*
und deren Verwendung zur Herstellung von Lebensmitteln" finden
Sie auf der Website:
http://vvgvg.org/
 Seitenanfang
Seitenanfang
*
Die Ergebnispräsentation
über das Leitprojekt Zöliakie wurde
von
Beate Schulte im
August/September 2005 angefertigt.
Sie
basiert auf dem Vortrag / Foliensatz © 2005
von Frau Dr. Gunvor
Pohl-Apel sowie auf einer Internetrecherche
Titel:
"Die
Bedeutung der Zöliakie in Wissenschaft und Forschung"
Referentin:
Frau
Dr. Gunvor Pohl-Apel (BioAlliance, Frankfurt) /
Projektkoordination)
Veranstaltung
/ Veranstaltungsort:
Erlebnistag
2005 der DZG e.V. in Brühl
Termin:
04. 06. 2005
Wir
bedanken uns an dieser Stelle sehr herzlich bei Frau Dr. Pohl-Apel für Ihr Engagement!
|